양분 용액의 농도
(1) 몰농도(molarity; M)
몰농도의 개념은 한 용액과 다른 용액이 반응하는 경우 '1M 용액'이란, 용액 1L 중에 1몰의 물질을 포함하는 용액이라고 정의된다. 실험적으로 1M 용액은 1몰의 용질을 용매 중에 녹여, 정확한 메스플라스크에서 최종적으로 1L로 될 때까지 희석시켜 만든다.
일반적으로, 용액의 몰농도(M)는 mol/L 또는 mmol/mL로 표시하는 것이 보통이며, M으로 약술하는 경우도 많다.
몰수(mol) = mol/L × L
=몰농도(M) ×L
리터(L) 단위는 소량의 용액을 취급할 때는 너무 커서 불편하므로 분석화학에서는 밀리리터(mL)단위를 더 많이 사용한다.
밀리몰수(mmol) = 몰농도(M) × mL
예제) 1.26g의 KNO3를 250mL의 메스플라스크에 넣고 눈금까지 묽혔다.
질산은용액의 몰농도를 계산하고, 몇 밀리몰의 KNO3가 녹았는지 계산하라.
1.26g/101.1g/mol
해답 M=1.26g/101.1g/mol = 0.0499mol/L (또는0.0499mmol/mL)
0.250L
∴ 밀리몰=(0.0499mmol/mL)(250mL)=12.47mmol
예제) 0.100Μ용액 500mL을 조제하는 데 몇 g의 MgSO4가 필요한가?
해답 500mL × 0.100mmol/mL = 50.0mmol
∴ 50.0mmol × 128mg/mmol × 0.001g/mg = 6.4g

(2) 노르말농도
비료 계산에서 유용한 농도 단위의 하나로 노르말농도(normality :N)가 있다. 1N 용액은 1당량/L를 포함한다. (즉 1L의 용액에 1당량의 용질을 포함한다) 몰농도 대신에 노르말농도를 사용하는 것이 유리한 경우가 많은 이유는, 대부분의 화학종들이 1:1 몰비보다 1:1의 당량비로 반응하는 경우가 많기 때문이다.
1당량(equivalent; eq)은 아보가드로 수(Avogadro's number; 6.02×1023) 만큼의 반응단위에 해당하는 물질의 질량에 상당한다. 따라서 당량수는 몰수와 반응단위수와 곱으로 주어진다. 당량무게(equivalent weight)는 화학식량을 반응단위수로 나눔으로써 얻어진다. 표는 여러 형태의 반응에 대한 반응단위의 보기를 나타낸 것이다.
| 무기원소 | 질소 (N) |
인 (P) |
칼륨 (K) |
칼슘 (Ca) |
마그네슘 (Mg) |
황 (S) |
| 원자량 | 14 | 31.0 | 39.1 | 40.1 | 24.3 | 32.1 |
| 원자가 | +1, -1 | -3 | +1 | +2 | +2 | -2 |
| 1당량 값 | 14 | 10.03 | 39.1 | 20.05 | 12.15 | 16.05 |
| 이온형태 | NO3-, NH4+ | PO43- | K+ | Ca2+ | Mg2+ | SO42- |
노르말농도는 몰농도와는 달리, 일어나는 반응의 내용 및 양적관계(즉, 반응식)를 명확하게 알아야 계산할 수 있다. 대표적으로, 산-염기 반응에서 반응단위수는 산이 주거나 또는 염기와 반응하는 양성자(proton; H+)의 수에 따라 결정된다.
한편, 산화-환원반응에서의 노르말 농도 산화제에 의하여 받거나, 또는 환원제에 의하여 공급되는 전자의 수에 의존한다. 예컨대, 황산(H2SO4)은 2반응 단위의 양성자를 가지며, 1몰마다 2당량의 양성자가 있다. 따라서, 황산의 당량은 다음과 같이 계산된다.
98.08g/mol
당량 = 98.08g/mol= 49.04g/eq
2eq/mol
산-염기반응이나 산화-환원반응 이외에도 침전의 생성(침전반응) 또는 용해성인 착물이 생성되는 반응(착물화법 적정)이 일어나는 적정반응이 있다. 이들의 반응에서 반응단위의 교환은 없으나, 분석성분(보통 금속성분)과 반응시약과의 결합은 일어난다. 이러한 경우, 금속이온의 전하를 반응단위라고 생각할 수 있으며, 따라서 당량은 그 금속이온의 원자량을 전하로 나눈 값과 같다.
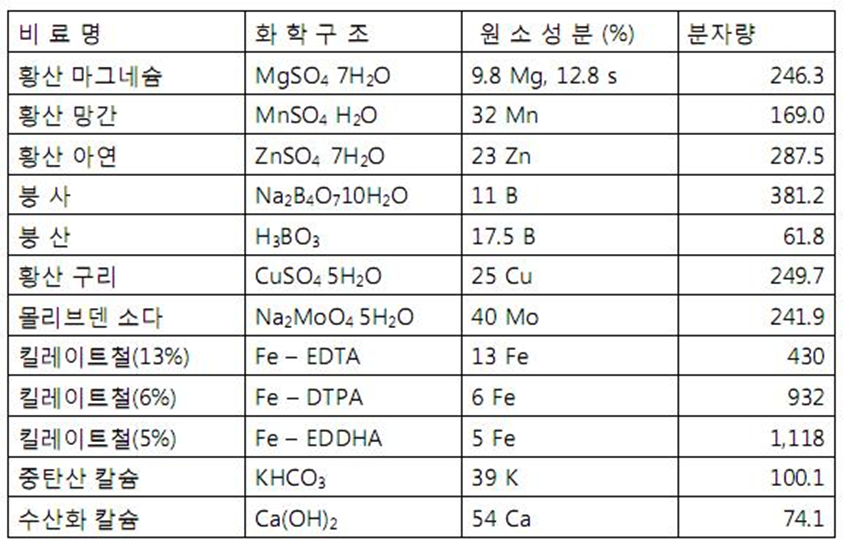
(3) 화학식량 농도
화학식량 농도(formality; F)라는 용어는 분자로서 존재하지 않는 이온결합성 염의 용액(예를 들어, NaCl 수용액)일 때 사용된다. 농도는 F로 나타내지만, 실제적인 응용 상으로는 화학식량 농도와 몰농도는 동일하다.
(4) 몰랄농도
물리화학에서 유용한 농도단위에 몰랄농도(m; molality)가 있다. 1몰랄(molal) 용액은 1000g의 용매속에 1몰을 포함한다. 몰랄농도는 어는점 내림, 끓는점 오름, 삼투현상(osmosis)과 같이 용액 중의 용매 1몰마다의 용질 입자수만으로 결정되는 물질의 성질을 물리화학적으로 표현할 때 편리한 단위이다. 몰랄농도는 용매의 부피와 무관하므로 용액의 온도가 변화하여도 몰랄농도는 변하지 않는다. 반면에 몰농도나 노르말농도는 온도에 의존한다.
'農 > 생리이야기' 카테고리의 다른 글
| 수소 이야기 (0) | 2021.12.27 |
|---|---|
| 식물과 생활 산도 (0) | 2021.12.24 |
| 지베렐린 사용법 (0) | 2021.02.12 |
| 질소, 토양의 뜨거운 감자 (0) | 2020.05.22 |
| ORP(산화 환윈 전위) (0) | 2020.05.22 |



