몰농도, 노르말농도 및 몰랄농도
비료계산에서 산과 같은 반응물을 첨가할 때에는 적당한 농도로 희석하여 반응을 시키는 것이 일반적이다. 이 때 사용되는 농도가 몰농도와 노르말농도이며 단위는 M과 N으로 나타낸다. 다음은 각 농도를 구하는 식을 정리한 것이다.
| 농도 | 계산식 | 단위 |
| 몰농도 (molarity) |
M, mol/L | |
| 노르말농도 (normality) |
N, g당량/L | |
| 몰랄농도 (molality) |
m, mol/kg |
| 예제 1 | 0.28M 황산용액의 3m3에 함유된 황산의 몰수와 질량을 구하라. |
| 풀이 | 풀이 1) 몰농도 공식에 주어진 값을 대입하면 0.28M=0.28/1L= x/3m3 x=0.28/1L × 3m3 × 1000L/1m3=840M 풀이 2) 황산 1몰은 98g 이므로 840몰 × 98g/몰 = 82,320g = 82.32Kg |
| 정답 | ∙ 840몰, 82320 g |
황산 1몰이 포함된 황산(H2SO4) 수용액 1500ml를 생각해 보자. 이 때 용액의 밀도는 1.1g/cm3 이다. 이 용액의 몰농도는 다음의 식으로 구할 수 있다.
| M농도=용액의 몰수/용액의 L수 = 1M/1500ml × 1000ml/L= 0.667M |
이 용액의 노르말 농도를 구하려면 황산 1몰이 몇 g당량인지 알아야 한다. g당량이란 용액 중에서 이온화되는 물질이 1몰 이온화될 때 내어놓는 전자의 몰수이다. 즉, 황산 1몰은 용액 중에서 2가 이온으로 이온화되므로 전자 2몰을 내 놓는다. 따라서 황산 1몰은 2g당량이다. 따라서 황산 용액의 노르말 농도를 구하면 다음과 같다.
| N농도=용액의 g당량수/용액의 L수 = 1M/1500ml × 2g 당량/1M × 1000ml/L= 1.333N |
염산(HCl)이나 질산(HNO3)처럼 용액 중에서 1가 이온으로 이온화되는 물질은 1몰이 1g당량이며 인산(H3PO4)처럼 3가 이온으로 이온화되는 물질은 1몰이 3g당량이 된다.
위의 황산 용액의 몰랄농도를 계산하려면 용매의 질량을 알아야하므로 황산용액의 밀도가 필요하다. 용액의 질량을 계산하면 다음과 같다.
| 용액의 질량=용액의 밀도/용액의 부피 = 1.1g/cm3 × 1500ml/L× 1cm3/1ml= 1.650g |
용액 중에 포함된 황산의 양은 1몰이므로 몰질량을 곱하면 황산 질량은 98g 이 된다. 따라서 용매인 물의 질량은 다음과 같다.
| 용매의 질량 = 용액의 질량 - 용질의 질량 = 1650g - 98g = 1552g |
용매의 질량을 이용하여 몰랄농도를 구하면 다음과 같다.
| 몰랄농도(molality)=용질의 몰수/용액의 kg수 = 1M/1552g × 1000g/1kg= 0.644m |





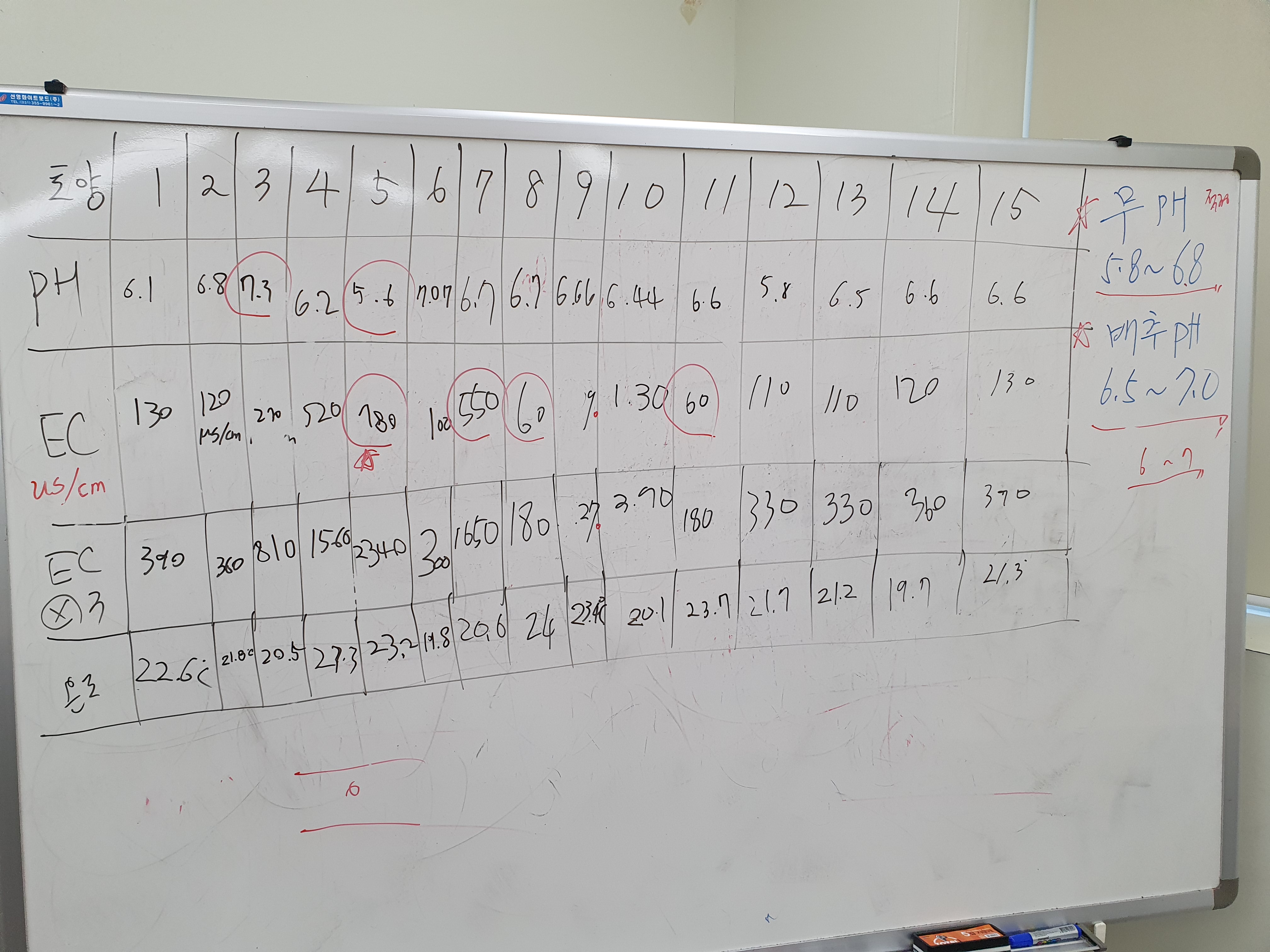


'敎 > 한국농수산대' 카테고리의 다른 글
| 식물체 영양분석 실습 (0) | 2021.11.27 |
|---|---|
| 인삼 연근판별 실습 (0) | 2021.11.13 |
| 실습동의 주인들 (0) | 2021.11.11 |
| 특용작물 현장 표정 (0) | 2021.09.09 |
| 캠퍼스는 마음의 고향 (0) | 2021.07.19 |



