토양 pH란 무엇인가?
토양 pH는 글자 그래도 “수소 이온의 양” 즉 토양 산성도의 측정값이다. 전문적으로, pH는 로그값으로 측정된 토양 수분에 존재하는 수소이온(H+)의 양을 말한다. 중요한 것은 pH가 어떻게 토양 화학구조와 식물 영양분에 영향을 주고, 그것을 어떻게 측정하고 관리하는지와 관계가 있다. pH는 0에서 14의 값을 갖는다.
낮은 pH(0~5)는 산성이고.
높은 pH(9~14)는 염기성이다.
pH6~8의 영역은 대략 중성 pH로 여겨진다.
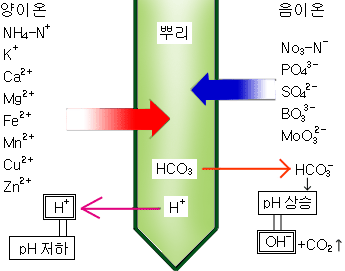
토양 산성도는 식물에 직접 해를 가하지 않는다. 그보다는 영양분의 식물에 대한 활성도에 영향을 준다.(이것은 아주 염기성인 토양에도 마찬가지이다.)
일반적인 비유를 사용하여 설명해본다. 토양을 식료품 저장실이라 상상해 보라. “먹기”위해서는 식료품 저장실 속에 음식이 들어있어야 한다.(모래가 많은 토양 또는 비가 많이 내리는 지역의 토양은 자주 영양분이 새어나가게 한다-“식료품 저장실”이 비어있는 것이다.) 토양 유기물을 다시 채워 넣는 것은 “식료품 저장실을 채워 넣는 것”과 같다. 모래, 미사, 찰흙, 유기물질이 골고루 섞여 있는 바람직한 토양은 여러 종류의 음식들이 채워진 커다란 식료품 저장실과 같다. 그런데 만약 토양 pH가 너무 낮거나, 너무 높으면 이것은 식료품 저장실이 점점 더 작아지는 것과 같다. 음식을 채울 공간이 없고, 당신이 음식을 채우려면 다른 음식을 딴 곳으로 옮겨주어야 한다.
산성 토양 개선하기
석회는 산성 토양을 개선하는 데에 이용되는 가장 보편적인 물질이다. 순수한 형태의 석회는 탄산칼슘(CaCO3)이다. 칼슘이 식물이 식물의 성장에 필요한 영양분이지만 석회에서 중요한 것은 칼슘(Ca++)이 아니다. 오히려, 산성 토양을 개선하는 것은 탄산(CO3-)이다. 이것은 수소 이온(H-)과 결합함으로써 이루어진다. 각각의 탄산이온은 두 개의 수소이온과 결합하고 이러한 방법으로 석회는 남는 H+를 씻어내고 토양 산성도를 중성으로 올려 준다.
이 반응의 공식은 다음과 같다.
2CaCO3 + 3H ↔ 2Ca++ + HCO3- + H2CO3
두 분자의 탄산칼슘에 대해 수소 이온 3개가 결합되고(pH를 낮춘다), 두 개의 칼슘 이온을 만들며(토양 속에 저장할 수 있는 것으로 식물에 의해 취해진다.) 그리고 2탄산과 탄산 각각 한 분자를 생성한다.
토양 pH를 중성으로 올리는 데에 필요한 석회의 양은 초기의 pH와 토양의 유형에 의존한다. 아래 표가 토양 pH를 올리는 데에 필요한 석회의 양을 나타낸 것이다.
'農 > 토양이야기' 카테고리의 다른 글
| 중국 식품이 우리 몸을 망친다 (0) | 2008.11.16 |
|---|---|
| 흙을 알면 환경농업이 보인다. (0) | 2008.10.04 |
| 완숙퇴비가 고품질 농산물을 만든다. (0) | 2008.04.20 |
| 뿌리를 죽이는 청산가리 (0) | 2008.04.20 |
| 토양 속 철의 순환 (0) | 2008.04.08 |